|
||||
|
|
25. Гидролиз соли Гидролиз соли – это взаимодействие соли с мо–лекулами воды, приводящее к образованию малодис-социироваииых соединений. Процесс гидролиза заключается в переходе протона от молекулы воды к данному иону (СO32- + НОН * НСO3–+ ОН- ) или от данного иона, в том числе от гидратиро-ванного катиона металла, к молекуле воды. В зависимости от природы соли вода выступает ли–бо как кислота, либо как основание, а соль является соответственно сопряженным основанием или сопря–женной кислотой. Возможны четыре варианта гидролиза в зависимо–сти от типа соли. 1. Соли, образованные сильной кислотой и слабым основанием: 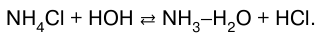 2. Соли, образованные сильным основанием и сла–бой кислотой: CH3COONa + НОН > СН3СOOН + NaOH. 3. Соли, образованные слабой кислотой и слабым основанием. Цианид аммония гидролизуется по реакции: 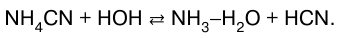 4. Соли, образованные сильной кислотой и сильным основанием. NaCl, KNO3 гидролизу не подвергаются. Механизм гидролиза солей заключается в поляризационном взаимодействии ионов соли с их гидратной оболоч–кой. Чем сильнее это взаимодействие, тем интенсивнее протекает гидролиз. Все рассмотренные случаи гидролиза касались солей, образованных однокислотными основаниями и одно– основными кислотами. Соли многоосновных кис–лот и многокислотных оснований гидролизуются ступенчато, образуя при этом кислые и основные соли. Количественно гидролиз как КО-равновесие характе–ризуется степенью гидролиза и константой гидролиза. Степень гидролиза измеряется отношением коли–чества гидролизованного вещества к общему коли–честву растворенного вещества. Степень гидролиза зависит от природы соли, ее кон–центрации и температуры. Согласно закону действую–щих масс степень гидролиза возрастает с разбавлением раствора. Так, при концентрации Na2CO3 0,001 моль/л степень гидролиза составляет 34%. В общем случае справедливы следующие законо–мерности. 1. Гидролиз соли должен усиливаться с повыше–нием температуры и разбавлением раствора. 2. При обратимом гидролизе в соответствии с прин–ципом Ле Шателье процесс должен подавляться при подкислении (если эта соль образована сильной кис–лотой и слабым основанием, накапливаются ионы Н) или при подщелачивании (если соль образована сла–бой кислотой и сильным основанием, накапливаются ионы ОН). 3. Гидролиз солей, в результате которого образуются малорастворимые или газообразные продукты, удаляю–щиеся из сферы реакции (принцип смещения равнове–сия), необратим. Например, гидролиз Pb(SO4)2 проте–кает полностью вследствие образования осадка PbO2: Pb(SO4)2 + 2Н2O > PbO2 + 2H2SO4. Гидролиз характерен для многих классов неоргани–ческих и органических соединений. Гидролиз неорга–нических соединений важен для оценки их токсично–сти. Гидролиз органических соединений применяют для получения ценных продуктов из древесины, жиров, эфиров и иного, но особенно важную роль гидролиз играет в жизнедеятельности живых организмов. |
|
||
|
Главная | В избранное | Наш E-MAIL | Добавить материал | Нашёл ошибку | Вверх |
||||
|
|
||||
