|
||||
|
|
ЛЕКЦИЯ № 4. Катализ 1. История открытия явления катализа Катализ – изменение скорости химической реакции в присутствии катализаторов. Самые простые научные сведения о катализе были известны уже к началу XIX в. Знаменитый русский химик, академик К. С. Кирхгоф, открыл в 1811 г. каталитическое превращение крахмала в сахар под действием разбавленных кислот. Эта реакция лежит в основе крахмалопаточного производства. А в 1814 г. он открыл фермент – амилазу, и им же было установлено, что эту реакцию может катализировать диастаза из ячменного солода, чем было положено начало изучению биологических катализаторов – ферментов. Четыре года спустя Г. Деви открыл способность паров спирта и эфира окисляться кислородом на платине. В 1822 г. И. Деберейнер установил, что при обычной температуре можно соединять водород и кислород на платине. Вскоре эти и многие другие открытия привели к установлению существования явлений, в 1833 г. названных Э. Митчерлихом контактными, а в 1835 г. И. Берцелиусом – каталитическими. В органической химии успехи катализа связаны с развитием теории строения органических соединений Бутлерова. Катализ в промышленности и живой природе Большую роль сыграли каталитические методы в развитии процессов органического синтеза. Следующим направлением использования катализатора является каталитическая очистка технологических газов, а также очистка сточных вод, загрязненных органическими веществами. В живой природе вся система управления жизненными процессами в организмах основана на катализе. Такие процессы, как брожение, дыхание, пищеварение, синтез белков и других соединений и т. п. осуществляется с помощью ферментов, называемых энзимами. 2. Механизм каталитического взаимодействия. Виды катализаторов Различают гомогенный и гетерогенный катализ. При однородном (гомогенном) катализе катализатор и реагенты образуют однородную систему. Пример: 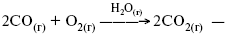 представляют однородную газовую фазу. Границы раздела между катализатором и реагентом отсутствуют. При гетерогенном – катализатор и реагирующие вещества находятся в разных фазах и отделены границей раздела. При этом катализатором является твердое тело, а реагенты находятся либо в газовой, либо в жидкой фазе. Пример: N2(г) + 3H2(г) > 2NH3(г). Существует еще микрогетерогенный катализ, при котором катализатор находится в коллоидном или в высокомолекулярном состоянии. Пример – биокаталитический процесс, катализаторами служат ферменты (энзимы). Есть еще автокаталитические процессы, когда катализатор – продукт самой реакции. Рассмотрим механизм каталитического взаимодействия в общих чертах. Пусть дана некая химическая реакция А + В = АВ. Без катализатора она протекает медленно. Как же она будет протекать с катализатором, по какой схеме? Ответим на данные вопросы. Катализатор взаимодействует с одним из реагентов, образуя промежуточные соединения по реакции А + К = АК. Затем уже это соединение реагирует с другим исходным веществом, при этом образуется продукт реакции АВ и выделяется еще катализатор. Напомним, катализатор – вещество, активно участ-вующее в химической реакции, но регенерирующееся (восстанав-ливающееся) после ее завершения, что мы и наблюдаем в ходе реакции АК + В = АВ + К. Главное преимущество катализатора в том, что он уменьшает энергию активации, увеличивая скорость реакции, но не влияет на термодинамические величины: ?U, ?H, ?S, ?G, ?F. |
|
||
|
Главная | В избранное | Наш E-MAIL | Добавить материал | Нашёл ошибку | Вверх |
||||
|
|
||||
