|
||||
|
|
ЛЕКЦИЯ № 11. Электрохимия 1. Понятие электрохимии Электрохимия – раздел физической химии, который рассматривает системы, содержащие ионы (растворы или расплавы электролитов) и процессы, протекающие на границе двух фаз с участием заряженных частиц. Первые представления о взаимосвязи химических и электрических явлений были известны в XVIII веке, так как было выполнено огромное количество физико-химических экспериментов с электрическим и грозовыми разрядами, с зарядами, находящимися в лейденских банках, но все они имели случайный характер из-за отсутствия постоянного мощного источника электрической энергии. Зарождение электрохимии связано с именами Л. Гальвани и А. Вольта. Занимаясь исследованием физиологических функций лягушки, Гальвани случайно создал электрохимическую цепь. Она состояла из двух различных металлов и препарированной лапки лягушки. Лапка одновременно являлась электролитом и индикатором электрического тока, но вывод был дан неправильный, т. е., согласно Гальвани, этот электрический ток, который возникал в цепи, имел животное происхождение, т. е. был связан с функциональными особенностями организма лягушки (теория «животного электричества»). Правильное толкование опытам Гальвани дал А. Вольта. Он создал первую батарею гальванических элементов – вольтов столб. Элементы батареи состояли из медных и цинковых дисков, а электролитом служил пропитанный соленой водой или кислотой губчатый материал. Именно такое соединение позволило получить электрический ток. Вскоре трудами великих ученых А. Вольта, Дж. Даниэля, Б. С. Якоби, П. Р. Багратиона, Г. Плантэ и др. появились удобные в работе мощные гальванические элементы и аккумуляторы. Затем А. Вольта разработал ряд напряжений металлов. Если два различных металла привести в соприкосновение, а затем разъединить, то при помощи физических средств, например, электроскопа, можно увидеть, что один металл приобрел положительный заряд, а другой – отрицательный. Этот ряд металлов, в котором каждый предшествующий металл заряжается положительно, но после контакта с любым последующим, т. е. ряд Вольта, оказался аналогичным ряду напряжений. Далее, в начале XIX века, был разработан электролиз, а М. Фарадей установил количественные законы электролиза. Большой вклад в развитие электрохимии внесли ученые: С. А. Аррениус, В. Ф. Оствальд, Р. А. Колли, П. Дебай, В. Нернст, Г. Гельмгольц и др. Сейчас электрохимия делится на теоретическую и прикладную. Благодаря использованию электрохимических методов, она связана с другими разделами физической химии, а также с аналитической химией и другими науками. 2. Электродные процессы Электродные процессы – процессы, связанные с переносом зарядов через границу между электродом и раствором. Катодные процессы связаны с восстановлением молекул или ионов реагирующего вещества, анодные – с окислением реагирующего вещества и с растворением металла электрода. Возможность протекания того или иного электродного процесса в общем случае определяется изменением ?H и ?S в ходе соответствующей химической реакции. Зная эти изменения, по уравнению Гельмгольца можно рассчитать минимальную величину напряжения, которое необходимо наложить на электроды для протекания данного электродного процесса. Например, на основании термодинамических данных для реакции 2Н2 + О2 = 2Н2О было установлено, что минимальное напряжение, необходимое для электрохимического разложения Н2О на Н2 и О2 =1,23В. Однако при таком напряжении между Hg катодом и Pt анодом для получения всего 1 см3 Н2 потребовалось бы около 400 тыс. лет. Чтобы увеличить скорость электродных процессов, не изменяя природы электродов, необходимо наложить на электроды значительно большую разность потенциалов. Например, для прохождения в рассмотренной системе электрического тока плотностью 1 А/см2 разность потенциалов между электродами должна составить 3,5 В. При этом только 35% электрической энергии затрачивается на реализацию электродного процесса, остальные 65% расходуются на нагревание электролита. Однако коэффициент полезного действия электрической энергии можно резко увеличить, если Hg катод заменить на Pt. Приведенный пример показывает, что термодинамический подход к изучению электродного процесса недостаточен. Значительно большее значение имеет исследование кинетики электродных процессов. С помощью меченых атомов можно показать, что электродные процессы всегда идут в двух направлениях. Например, при восстановлении Cu2+ на медном электроде одновременно с реакцией Cu2+ + 2e- >Cu0 идет, хотя и с меньшей скоростью, ионизация Cu. При отсутствии внешнего тока скорости прямого и обратного электродного процесса равны между собой и равны плотности тока обмена, которая характеризует собственную скорость электродного процесса. При пропускании внешнего тока скорости электродного процесса в прямом и обратном направлениях различаются на величину плотности тока i. В этих условиях потенциал электрода отличается от своего равновесного значения. Сдвиг потенциала электрода от его равновесного значения при электродном процессе – поляризация. Абсолютная величина поляризации – ?(перенапряжение). Чем больше плотность тока обмена, тем меньше при заданном значении iотклонение электрохимической системы от равновесия, и тем меньше перенапряжение. Таким образом, при заданном значении iвеличина ?характеризует собственную скорость данного электродного процесса. Поэтому задача электрохимической кинетики заключается в том, чтобы связать уравнением величину ?с плотностью тока и с другими параметрами электрохимической системы. Зная эту закономерность, можно сознательно регулировать скорость исследуемых электродных процессов. Электродные процессы – гетерогенные, и поэтому состоят из ряда последовательных стадий. Суммарная скорость электродного процесса в этих условиях определяется скоростью самой медленной стадии. Это означает, что суммарная величина ?складывается из значений ?для различных стадий: самая медленная стадия при заданной i даст самую большую составляющую ?, по сравнению с которой другими составляющими ?пренебрегают. Пример. Рассмотрим стадии электродного процесса на примере разряда ионов Н3О с образованием Н2 (газ). 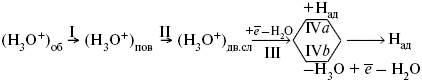 Стадия I – перенос ионов Н3О+ из объема раствора к поверхности электрода за счет диффузии под действием электрического поля (миграция) или за счет перемешивания раствора (конвекция). Если максимально возможная в данных условиях скорость переноса ионов Н3О+ соответствует плотности тока iд, то для стадии I: 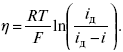 Стадия II – вхождение иона Н3О+ в ДЭС. Химические закономерности этой стадии были впервые рассмотрены В. Г. Левичем в 1949 г. Как показали более поздние исследования П. Делахея, скорость стадии II может существенно отразиться на общей скорости электродного процесса, лишь в случае электростатического отталкивания реагирующей частицы от электрода в условиях очень быстрой последующей стадии разряда (например, при разряде ионов Hg2+ на положительно заряженной поверхности Hg). Стадия III – собственно электрохимическая стадия разряда. Медленность этой стадии в рассматриваемом примере обусловлена очень большой энергией связи протона с молекулой Н2О в разряжающемся ионе Н3О+. Согласно теории замедленного разряда, впервые предложенной М. Фольмероми Т. Эрдей-Грузомв 1930 г., а затем развитой А. Н. Фрумкиным в 1932 г. с учетом строения ДЭС для стадии III: 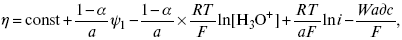 где ?– const 0 < a <1; ?1 – потенциал на расстоянии среднего ионного радиуса от поверхности электрода; Wadc – энергия адсорбции атомов Н на поверхности металла. Приведенное уравнение дает зависимость перенапряжения от плотности тока, состава раствора и природы металла (через Wadc) и в большинстве случаев хорошо согласуется с экспериментальными данными. В частности, стадия III определяет общую скорость электрохимической реакции при использовании в качестве электрода: Hg, Pb, Sn, Zn, Tl. Стадия IVa – рекомбинация адсорбированных атомов водорода в молекулы Н2. Впервые выражение для этой стадии получил Ю. Тафель в 1905 г. В 1930 г. эта теория развилась в работе Н И. Кобозева и Н И. Некрасова, которые учли энергию адсорбции атомов Н на поверхности электрода. Стадия IVa: 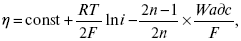 где п > 1 – const. Одновременно Н И. Кобозевым и Н И. Некрасовым была рассмотрена возможность удаления адсорбции Н путем эмиссии атомов Н в раствор. Стадия IVa является заметным вкладом в суммарную величину ?при использовании в качестве электродов металлов, которые хорошо адсорбируют водород: Pt, Fe, Ni. Механизм удаления ад.Н, соответствует стадии IVб, был предложен Я. Гейровским в 1925 г. – электрохимическая десорбция. Поскольку в стадии IVб применяют участие ионы Н3О+ и электроны металла, то зависимость скорости этой стадии от состава раствора и от потенциала электрода такая же, как и в стадии III. Экспериментально существование стадии IVб было доказано для электродов из Fe и Ni. 3. Катодные и анодные процессы в гальванотехнике Основными процессами в гальванотехнике являются восстановление и снижение. На Kat – восстановление, где Kat – катод. На An – снижение, где An – анод. Электролиз H2O: 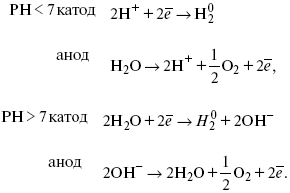 Катодные реакции 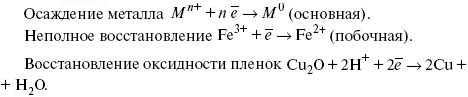 Последняя реакция протекает свыделением водорода. 4. Современные направления в развитии термодинамической и прикладной электрохимии Наиболее важная стадия любого электрохимического процесса – стадия переноса заряда, она протекает на межфазной границе электрод-электролит в пределах ДЭС, в его плотной части (слой Гельмгольца). Особенностью стадии переноса зарядов является обязательное участие электронов в процессе, источник электронов – металл или электрод; ионы раствора в свободном виде или в виде комплексов диффундируют (перемещаются посредством диффузии к межфазной границе), входят в плотный слой Гельмгольца, то есть адсорбируются на поверхности электрода за счет электростатических сил; в слое Гельмгольца ионы принимают или отдают электрон; процесс переноса электронов, степень переноса заряда с электрода на реагирующую частицу или обратно определяется или зависит от электрического поля ДЭС. Образующиеся продукты реакции уходят в раствор (десорбируются с поверхности) или образуют на поверхности новую фазу, такой новой фазой являются: металлопокрытия (осадки металла), осадки оксидов или нерастворимых солей. С образованием новой фазы дальнейшее протекание процесса будет зависеть от свойств в этой фазе, в частности от диффузии образующихся частиц через слой фазы. В зависимости от соотношения коэффициента диффузии реагирующих частиц в слое фазы, дальнейшее протекание электродного процесса может концентрироваться или на внешней границе новой фазы (раствор электролита), или на внутренней границе, где образовавшаяся фаза соприкасается с электродом. В связи с этим любой электрохимический процесс включает стадии диффузии, адсорбции, переноса заряда, кристаллизации новой фазы. Скорость суммарного процесса будет определяться скоростью самой медленной стадии. Соответственно этому различают электрохимические процессы, протекающие с перенапряжением диффузии, с перенапряжением переноса заряда, перенапряжением кристаллизации. Процесс кристаллизации – частный случай гетерогенной химической реакции. Возможны реакции, скорость которых лимитируется химической реакцией, протекающей у поверхности электрода (перенапряжение гомогенной химической стадии). Кинетические характеристики каждой из лимитирующих стадий можно определить с помощью следующих электрохимических методов: метод гальваностатической кривой – потенциал, время (хронопотенциометрия); метод потенциостатических кривых – плотность тока, время (хроноамперометрия); метод потенциодинамических кривых (хроновольтамперометрия): особенностью метода является то, что изменение ?Toка во времени регистрируется параллельно с изменением потенциала. Потенциал на электрод подается с определенной линейной скоростью. Все эти методы могут использоваться в ячейках с вращающим дисковым электродом. Кинетические характеристики любого электрохимического процесса: ?тoкообмена – i0; константа скорости в стадии переноса заряда – к; энергия активации А; iд – предельный ток диффузии (гетеро); iд – предельный ток реакции (гомо); iкр – предельный ток кристаллизации. Для них можно использовать метод переменного тока, который позволяет проводить измерения С – емкостной, R – омической составляющей импеданса электрода в условиях, близких к равновесным, в отсутствии внешней поляризации постоянным током, вблизи равновесного потенциала. Твердофазные процессы также характеризуются сложным механизмом, то есть включают несколько стадий: поверхностная диффузия (диффузия в твердой фазе), взаимодействие диффундирующих частиц на поверхности, с образованием зародышей новой фазы, участие их в процессе кристаллизации. В последние годы накоплен большой экспериментальный материал, который показывает, что электроны могут переходить в раствор и там существовать длительное время в виде самостоятельных частиц. Присутствие электронов в растворе в сольватированном виде может значительно изменять структуру раствора и оказывать влияние на механизм поведения компонентов раствора в ДЭС. Это направление широко развивается, так как открывает возможности для создания принципиально новых технологий, получения новых материалов. Это направление – электронная электрохимия. В настоящее время с помощью различных физико-химических методов достаточно подробно изучена диффузия водорода в металлах и сплавах. Полученные данные способствуют развитию применения водорода в энергетике (топливные элементы и солнечные батареи), а так же радиотехнике и оптоэлектронике. Открытие металлической связи в водородном соединении металлов используется для разработки «элементов памяти», которые способны реагировать на внешние воздействия и восстанавливать свою форму после прекращения такого воздействия. Кроме того, благодаря открытию металлической связи развиваются «аккумуляторы Н2», которые представляют собой металлические сплавы, способные поглощать большие количества Н2, а при каком-либо внешнем воздействии выделять этот Н2 для практического применения (металлогидридные аккумуляторы). |
|
||
|
Главная | В избранное | Наш E-MAIL | Добавить материал | Нашёл ошибку | Вверх |
||||
|
|
||||
